ОПЫТ ПРИМЕНЕНИЯ КОМБИНИРОВАННОЙ ТЕРАПИИ АГРЕССИВНОГО РЕМИТТИРУЮЩЕГО РАССЕЯННОГО СКЛЕРОЗА МИТОКСАНТРОНОМ В СОЧЕТАНИИ С КОПАКСОНОМ
Сазонов Д.В.1,2, Малкова Н.А.1,2,3, Булатова Е.В.2, Рябухина О.В.1
1 Окружной Центр Рассеянного Склероза ФГУ «СОМЦ Росздрава»
2 Областной Центр Рассеянного Склероза ОГУЗ ГНОКБ
3 Кафедра Клинической Неврологии и Алготерапии ФПК и ППВ НГМУ
Рассеянный склероз (РС) – прогрессирующее аутоиммунное заболевание, в основе патогенеза которого лежит хронический процесс воспалительной демиелинизации и нейродегенерации в центральной нервной системе, проявляющееся вариабельной неврологической симптоматикой [1, 2]. Обычно заболевание начинается в молодом возрасте и практически неизбежно ведет к инвалидизации. Выключение в связи с этим большого числа трудоспособных людей из активной жизни, большие расходы на диагностику, лечение, реабилитацию и социальную помощь делают проблему РС социально и экономически значимой [3].
Общепринято мнение, что РС, самое распространенное демиелинизирующее заболевание, является мультифакториальным. Его развитие обусловлено взаимодействием факторов внешней среды (вируса и/или другого патогена, экологических и географических факторов) и наследственной предрасположенностью, реализуемой полигенной системой, включающей особенности иммунного ответа и определенного типа метаболизма [4]. Сочетание внешних и генетических факторов в конечном итоге приводит к развитию аутоиммунного процесса, направленного против нервной ткани с образованием очагов демиелинизации и нейродегенерации [5].
Рассеянный склероз – заболевание с доказанным аутоиммунным патогенезом, поэтому все стратегии лечения с доказанной эффективностью так или иначе имеют в механизме своего действия точки приложения в иммунной системе. Препараты группы интерферонов-β (Ребиф, Авонекс, Бетаферон) и глатирамера ацетат (Копаксон) относятся к группе иммуномодуляторов. На более поздних стадиях заболевания и в тех случаях, когда течение приобретает злокачественный характер, либо является таковым с самого дебюта, иммуномодулирующей терапии недостаточно и встаёт вопрос о назначении иммуносупрессивных препаратов, в качестве которых традиционно применяют некоторые цитостатики: циклофосфан, метотрексат и азатиоприн. В последние годы всё более широкое применение в терапии агрессивного РС находят так называемые «цитостатики второго поколения» – синтетические противоопухолевые препараты, которые обладают узконаправленным действием на иммунокомпетентные клетки, такие как кладрибин и митоксантрон. Они имеют меньше побочных эффектов по сравнению с препаратами первого поколения и лучше переносятся больными.
Наиболее применяемой на сегодняшний день является терапия быстро прогрессирующего РС митоксантроном в сочетании с метилпреднизолоном.
Митоксантрон – синтетический противоопухолевый препарат. В онкологии митоксантрон применяют в основном при гемобластозах: неходжкинских лимфомах, острых лейкозах у взрослых, при обострениях хронического миелолейкоза, также он используется при метастазирующем раке молочной железы. Митоксантрон реализует свое противоопухолевое действие, интерполируясь в ДНК, и образуя разрывы цепи ДНК и межцепевые связи. Таким образом, препарат избирательно подавляет пролиферацию быстро делящихся клеток. Механизм действия препарата при рассеянном склерозе связан с подавлением активности Th1-хелперов, В-клеток и стимуляции апоптоза воспалительных Т-клеток.
Наиболее масштабным клиническим исследованием эффективности и безопасности митоксантрона было Европейское (Германия, Бельгия, Венгрия и Польша) многоцентровое исследование MIMS (Mitoxantrone In progressive Multiple Sclerosis). В целом митоксантрон хорошо переносился и сокращал прогрессирование инвалидизации и клинических осложнений [7].
Помимо клинических и нейровизуализационных изучаются и лабораторные критерии эффективности терапии митоксантроном. В последних исследованиях показано, что митоксантрон, помимо уже известного влияния на Т-клетки, значительно снижает уровень аутореактивных В-клеток [13].
По сравнению с другими химиопрепаратами, митоксантрон относительно прост в применении и имеет минимальное количество побочных эффектов в период приема. Тем не менее, при применении митоксантрона, как и других аналогичных химиотерапевтических препаратов, возможно угнетение кроветворения (лейкопения, тромбоцитопения, реже – эитроцитопения). Увеличивается риск развития у пациентов кардиотоксичности, проявляющейся в форме кардиомиопатии, в сокращении выделения фракций левого желудочка и в закупорке сердечных сосудов, поэтому общая доза на протяжении всей жизни, превышающая 140 мг/м2 не рекомендуется. Могут возникать тошнота, рвота, понос, общая слабость, повышение температуры тела, аменорея, алопеция и другие побочные эффекты. Наиболее серьёзным отсроченным побочным эффектом является развитие митоксантрон-индуцированных гемобластозов, протекающего чаще всего в виде острого лимфобластного лейкоза. Кроме того, существует опасение, что митоксантрон может увеличить вероятность развития злокачественных опухолей в будущем, поскольку его влияние на ДНК допускает теоретическую возможность мутагенного и канцерогенного действия.
Учитывая вышеуказанные проблемы, при ведении пациентов с агрессивным ремиттирующим РС на настоящее время наиболее предпочтительными являются схемы комбинированной терапии, включающие фазу индукции, в которой ведущими являются иммуносупрессивные препараты, и фазу поддерживающей терапии препаратами ряда иммуномодуляторов. Использование схем комбинированной терапии даёт ряд преимуществ: во-первых, они позволяют снизить суммарную дозу иммуносупрессанта, что значительно уменьшает риск развития осложнений; во-вторых, становится возможным проведение нескольких (от трёх до четырёх) коротких стабилизирующих курсов иммуносупрессивной терапии в случае последующего ухудшения состояния больного.
Выбор препаратов для создания комбинаций, а также построение протоколов лечения должно проводиться с учётом особенностей механизма действия препаратов, спектра их побочных эффектов, особенностей введения иммуносупрессантов и иммуномодуляторов. Первыми были применены протоколы комбинированной терапии на основе препаратов β-интерферонов: Ребиф+Метотрексат [14], Бетаферон+Азатиоприн [15], Бетаферон+Митоксантрон [16]. Эти схемы разрабатывались в первую очередь на основании общности механизмов действия этих препаратов – снижении проницаемости гематоэнцефалического барьера и прямом противовоспалительном действии. Они показали свою эффективность и хорошую переносимость, однако не было достигнуто значительного расширения механизмов действия комбинации препаратов по сравнению с монотерапией. Для наиболее эффективного использования возможностей комбинированной терапии были разработаны варианты на основе препаратов с разнонаправленными механизмами действия – митоксантрона и копаксона.
Первым сообщением об эффективном использовании в лечении высокоактивного ремиттирующего РС последовательной поддерживающей терапии копаксоном после проведения стабилизирующих курсов митоксантрона была работа британских исследователей, опубликованная в 2006 году [17]. Ещё одним крупным исследованием эффективности комбинированной терапии митоксантроном и копаксоном была работа американских исследователей, опубликованная в 2008 году [18, 19].
По результатам этих исследований был сделан вывод о высокой эффективности комбинированной терапии агрессивного ремиттирующего РС комбинированной терапией митоксантроном в сочетании с копаксоном, превышающей эффективность монотерапии копаксоном как по клиническим (частота обострений), так и томографическим (число гадолиний-накапливающих очагов) данным. Большинство нежелательных эффектов терапии связано с митоксантроном, но их выраженность остаётся умеренной, и не требовала прекращения терапии.
Целью нашей работы являлась оценка эффективности, безопасности и переносимости комбинированной терапии агрессивного ремиттирующего рассеянного склероза митоксантроном в сочетании с копаксоном.
Задачи
1. Оценить клинические и томографические показатели эффективности комбинированной терапии агрессивного ремиттирующего рассеянного склероза митоксантроном в сочетании с копаксоном.
2. Оценить клинические и параклинические показатели безопасности и переносимости комбинированной терапии агрессивного ремиттирующего рассеянного склероза митоксантроном в сочетании с копаксоном.
Материалы и методы.
Агрессивным считается такое течение ремиттирующего РС, при котором у пациента наблюдаются высокие показатели клинической и томографической активности процесса: частота обострений 3 за 2 года и более, как правило, с неполным восстановлением, накоплением остаточного неврологического дефицита и активными очагами на МРТ.
На сегодняшний день в отборе пациентов для включения в программу комбинированной терапии митоксантроном в сочетании с копаксоном мы руководствуемся следующими критериями (таб. 1):
Таблица 1. Критерии включения и исключения для проведения комбинированной терапии митоксантроном в сочетании с копаксоном.
|
Критерии включения |
Критерии исключения |
|
- Достоверный диагноз ремиттирующего рассеянного склероза согласно критериям W. Ian McDonald’2005; - Степень инвалидизации по шкале EDSS 3,0-6,5 баллов; - Продолжительность заболевания более 1 года; - Как минимум 3 клинически подтверждённых обострения за последние 2 года; - Высокая активность болезни (+1,0 и более баллов EDSS за последний год); - Возраст от 18 до 55 лет; - Активные контрастируемые очаги по данным МРТ; - Достаточная мотивация больного; - Отсутствие тяжёлой соматической патологии. |
- Прогрессирующие формы РС; - Оценка по шкале Куртцке EDSS менее 3 и более 6,5 баллов; - Частота обострений 1 раз в год и менее; - Умственная (ментальная) дисфункция больного; - Тяжелая сопутствующая патология (заболевания сердечно-сосудистой, дыхательной, мочеполовой систем); - Несогласие больного. |
Под нашим наблюдением находится 9 больных агрессивным ремиттирующим РС, из них 5 мужчин и 4 женщины, средний возраст к началу терапии составил 26,1 лет (21-33). Средняя длительность заболевания к началу терапии составляет 4,8 лет (1,5-12,0). 2 больных закончили лечение, 7 продолжают терапию. На момент начала терапии все пациенты имели ремиттирующее течение, оценка неврологического дефицита по шкале Куртцке EDSS в среднем составила 5,3 баллов (4,0-6,0) до начала терапии. Частота обострений составляла 1,3 в год. Средняя скорость прогрессирования составила 1,8 балла в год.
В нашей работе мы использовали модифицированную схему введения митоксантрона, предложенную J. Ramtahal et al [17]. Пациенты получали по 10 мг/м2 ежемесячно в первые три месяца с переходом на 5 мг/м2 1 раз в 3 месяца (2 курса), начало инъекций копаксона – с 4 месяца. Учитывая, что все пациенты на момент включения находились в состоянии обострения, мы сочли целесообразным подключение внутривенных стероидных препаратов (метилпреднизолона) аналогично схеме, применяемой нами при иммуносупрессивной терапии митоксантроном в сочетании с метилпреднизолоном [20] (рис. 1).

Рис. 1. Протокол комбинированной терапии Митоксантроном в сочетании с Копаксоном при агрессивном ремиттирующем рассеянном склерозе.
Анализ эффективности терапии в нашем исследовании мы проводили с использованием показателей частоты обострений, балла EDSS до начала исследования и на момент последней оценки состояния. В качестве метода нейровизуализации мы использовали МРТ головного мозга с контрастированием. Все пациенты перед началом лечения и после заключительного курса терапии митоксантроном проходили УЗИ сердца для исключения вероятной кардиомиопатии и ЭКГ перед каждым введением препарата. Все больные проходили общеклиническое обследование: общий анализ крови с подсчётом лейкоцитарной формулы, общий анализ мочи, биохимический анализ крови, ЭКГ, оценку жизненно важных показателей (АД, ЧСС, ЧД), общесоматического статуса как минимум, раз в 3 месяца.
Результаты и обсуждение.
Частота обострений и динамика степени тяжести по шкале EDSS на фоне комбинированной терапии митоксантроном в сочетании с копаксоном отражены в таблице (рис. 2) и на графике (рис. 3). Среднее исходное значение EDSS (перед проведением первого курса терапии) составило 5,3 балла. Сразу же после первого курса среднее значение инвалидизации достоверно (p<0,01) снизилось, составив 4,6 балла, после второго курса ИСТ показатель вновь достоверно снизился, достигнув 4,4 балла и не претерпевал значимых изменений вплоть до заключительного, пятого введения митоксантрона. В общей сложности к 8 месяцу терапии средний балл EDSS снизился на 1,1 балла (с 5,3 до 4,2).
Эффективность лечения, оцениваемая по изменению показателей инвалидизации пошкале EDSS, была следующей; с улучшением – 78% (9 больных), с ухудшением – 22% (2 больных).
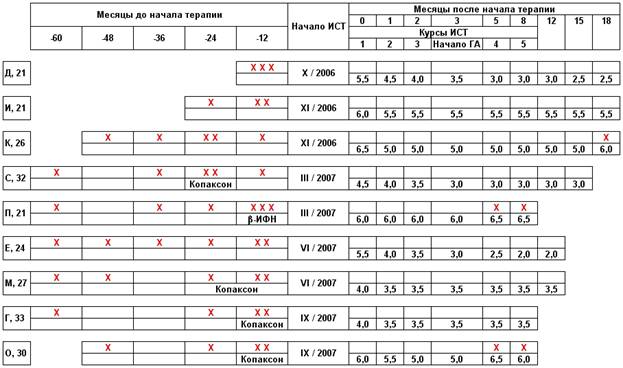
Рис. 2. Обострения и изменение степени инвалидизации по шкале EDSS на фоне комбинированной терапии Митоксантроном в сочетании с Копаксоном (Х – обострение).
Частота обострений, составлявшая до начала терапии 1,3 в год, на фоне проведения терапии уменьшилась до 0,5 обострений в год. При этом 6 пациентов (66,7% от общего числа) после начала терапии не имели ни одного обострения в течение как минимум 12 месяцев. Все они не имели новых или накапливающих гадолиний очагов на МРТ, проводимых через 6 и 12 месяцев после начала терапии.

Рис. 3. Динамика степени инвалидизации по шкале EDSS на фоне комбинированной терапии Митоксантроном в сочетании с Копаксоном (*p<0,01; **p<0,05).
Таким образом, можно сделать вывод о высокой эффективности терапии агрессивного ремиттирующего рассеянного склероза митоксантроном в сочетании с копаксоном. Однако в исследуемой группе были зарегистрированы два случая, когда терапия была недостаточно эффективной.
Больная П., 21 год, заболела в возрасте 17 лет, дебют – с нарушения двигательных функций (выраженная слабость в ногах после умеренной физической нагрузки). На момент начала терапии митоксантроном стаж заболевания составил 4,5 года, степень инвалидизации по шкале EDSS – 6,0 баллов, скорость прогрессирования – 1,33 балла в год. До включения в программу пациентка в течение 1 года получала терапию бетафероном, на фоне которой зафиксировано 3 обострения. После введения первой дозы митоксантрона у пациентки на ЭКГ зарегистрирована частая экстрасистолия с нагрузкой на правые отделы сердца, но без выраженных гемодинамических нарушений по эхокардиоскопии. Ко времени второго введения митоксантрона (через 1 месяц) нарушения на ЭКГ выражались в редких экстрасистолах, однако, после проведения курса терапии ситуация повторилась, на основании этого было решено уменьшить дозу митоксантрона до 5 мг/м2. За период до начала терапии копаксоном инвалидизация больной не уменьшилась, составляя 6,0 баллов по шкале EDSS. На момент четвёртого введения митоксантрона у пациентки было зафиксировано обострение, выражавшееся в усугублении двигательного дефицита (потребовалась двусторонняя поддержка при передвижении), в связи с чем в лечении были добавлены кортикостероиды (метилпреднизолон 1000 мг в течение 3 дней) и плазмаферез (3 сеанса), через 3 недели обострение было купировано. Пациентка продолжала терапию копаксоном, на фоне чего было зарегистрировано повторное обострение через 2 месяца после предыдущего со схожей симптоматикой и потребовавшее аналогичную дополнительную терапию. В связи с очевидной неэффективностью комбинированной терапии пациентка, начиная с пятого введения митоксантрона, была переведена в протокол стандартной иммуносупрессивной терапии митоксантроном в сочетании с метилпреднизолоном с половинной дозировкой митоксантрона ввиду неудовлетворительной переносимости полных доз.
Больной О., 30 лет, заболел в возрасте 27 лет, дебют – с мозжечковых нарушений, глазодвигательных расстройств (выраженная атаксия, головокружение, двоение в глазах при взгляде во все стороны и прямо). На момент начала терапии митоксантроном стаж заболевания составил 2,5 года, степень инвалидизации по шкале EDSS – 6,0 баллов, скорость прогрессирования – 2,5 балла в год. До включения в программу пациент в течение полугода получал терапию копаксоном, на фоне которой зафиксировано 2 обострения. После введения первой дозы митоксантрона степень инвалидизации по шкале EDSS снизилась до 5,5, после второго – до 5,0 баллов и оставался на этом уровне до начала терапии копаксоном. Через 2 месяца после третьего введения митоксантрона у пациента было зафиксировано обострение, выражавшееся в значительном ухудшении двигательных функций (двусторонняя поддержка при ходьбе), в связи с чем в лечении были добавлены кортикостероиды (метилпреднизолон 1000 мг в течение 3 дней), через 2 недели обострение было купировано, пациент смог передвигаться без поддержки. Пациент продолжал терапию копаксоном, на фоне чего было зарегистрировано повторное обострение (до 6,0 баллов EDSS) через 1 месяц после четвёртого введения митоксантрона с усугублением пирамидных и мозжечковых нарушений, потребовавшего аналогичной дополнительной терапии. В связи с очевидной неэффективностью комбинированной терапии пациент, начиная с пятого введения митоксантрона, был переведён в протокол стандартной иммуносупрессивной терапии митоксантроном в сочетании с метилпреднизолоном с полной дозировкой митоксантрона.
На основании имеющегося опыта неудачных случаев применения комбинированной терапии митоксантроном в сочетании с копаксоном можно сделать следующие наблюдения. Во-первых, не рекомендуется переводить пациента на монотерапию копаксоном в том случае, если он по какой-либо причине (особенно ввиду плохой переносимости) не получил в течение трёх первых введений митоксантрона его полную расчетную дозу (30 мг/м2). Во-вторых, эффект от комбинированной терапии митоксантроном в сочетании с копаксоном представляется сомнительным в том случае, если на фоне предшествующей терапии копаксоном длительностью не менее полугода у пациента была зафиксированы очень высокие частота обострений и скорость прогрессирования. В таких случаях рекомендуется проведение ИСТ митоксантроном в переносимой дозировке в сочетании с метилпреднизолоном.
В группе больных наблюдались следующие побочные эффекты: два случая лёгкой гипербилирубинемии, два случая лёгкой анемии (уровень гемоглобина – не менее 100 г/л), трое пациенток предъявляли жалобы на нарушения менструального цикла, также зафиксированы два случая алопеции, два случая экстрасистолии (включая вышеописанный), а также эпизоды тахикардии до 120 ударов в минуту – у трёх пациентов, один случай Herpes Zoster.
Таким образом, использование митоксантрона в сочетании с копаксоном при лечении агрессивного ремиттирующего РС позволяет значительно уменьшить частоту обострений, в большом проценте случаев добиться улучшения состояния больных. Использование сочетания препаратов позволяет значительно уменьшить необходимую курсовую дозу митоксантрона (40 мг/м2) и увеличить возможные сроки проведения терапии (практически неограниченно после перехода на монотерапию копаксоном).
Выводы.
1. У большинства больных с агрессивным ремиттирующим рассеянным склерозом (77,8%) на фоне комбинированной терапии митоксантроном в сочетании с копаксоном отмечена стабилизация или улучшение состояния по шкале EDSS, частота обострений уменьшилась с 1,3 в год до 0,5 обострения в год.
2. Комбинированную терапию по митоксантроном в сочетании с копаксоном больные переносят удовлетворительно. Тяжелых осложнений на фоне лечения не отмечено.
Литература
1. Е.И. Гусев, И.А. Завалишин, А.Н. Бойко // Рассеянный склероз и другие демиелинизирующие заболевания - 2004.
2. Е.И. Гусев, Т.Л. Демина, А.Н. Бойко // Рассеянный склероз - 1997. - С. 2.
3. Т.Е. Шмидт, Н.Н. Яхно // Рассеянный склероз. – 2003. - С.7.
4. Н.А. Малкова, А.П. Иерусалимский // Рассеянный склероз. - 2006. - С. 6, 123.
5. Е. И. Гусев, А.Н. Бойко // Рассеянный склероз: от новых знаний к новым методам лечения, Российский медицинский журнал - 2001. - №1. - С. 5.
7. Hartung H.P., Gonsette R., Konig N., Kwiecinski H., Guseo A., Morrissey S.P. et al. // Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, double-blind, randomised, multicentre trial. Lancet. 2002; 360: 2018-2025.
8. Watson C.M., Davison A.N. et al. // Suppression of demyelination by mitoxantrone. International Journal of Immunopharmacology. – 1991. - 13:923-930.
9. Millefiorini E., Gasperini C., Pozzilli C., et. all. // Randomized placebo-controlled trial of Mitoxantrone in Relapsing/Remitting Multiple Sclerosis: 24-month clinical and MRI outcome. Journal of Neurology. - 1997. - 244(3):153-159.
10. Edan G., Miller D., Clanet M., et. al. // Therapeutic effect of Mitoxantrone combined with Methylprednisolone in Multiple Sclerosis: a randomized multicentre study of active disease using MRI and clinical criteria. - Journal of Neurology, Neurosurgery and Psychiatry. – 1997. - 62(2):112-118.
11. Edan G., Miller D., Clanet M., et al. // Mitoxantrone plus methylprednisolone improved active multiple sclerosis. – Journal of Neurology, Neurosurgery and Psychiatry. 1997. - 62:112-8.
12.Kkolou E., Toufexis J., Gaglia E., Pantzaris M. // Clinical effect of Mitoxantrone in patients with multiple sclerosis. - Multiple Sclerosis – Clinical and laboratory research, ECTRIMS 2006. P. 210.
13. Putzki N., Kumar M., Kreuzfelder E., Limmroth V. // Mitoxantrone leads to a persistent selective decrease of the B cell count in patients with multiple sclerosis. - Multiple Sclerosis – Clinical and laboratory research, ECTRIMS 2006. P. 211-212.
14. Calabresi P.A. et al. // An open-label trial of combination therapy with interferon β-1a and oral mthotrexate in MS. - Journal of Neurology. 2002; 58: 314-317
15. Pulicken M. et al. // Optimization of the safety and efficacy of interferon beta 1b and azathioprine combination therapy in multiple sclerosis. - Multiple Sclerosis. 2005; 11: 169-174
16. Jeffery D.R. et al. // A pilot trial of combination therapy with Mitoxantrone and interferon beta-1b using monthly gadolinium-enhanced magnetic resonance imaging. - Multiple Sclerosis. 2005; 11: 573-582
17. Ramtahal J., Jacob A., Das K., Boggild M.. // Sequential maintenance treatment with glatiramer acetate after Mitoxantrone is safe and can limit exposure to immunosuppression in very active relapsing remitting multiple sclerosis. - Journal of Neurology. 2006: 1-5.
18. Vollmer T., Panitch H., Bar-Or A. et al. // Glatiramer acetate after induction therapy with Mitoxantrone in relapsing multiple sclerosis. - Multiple Sclerosis. 2008; 253: 1160-1164.
19. Gold R. // Combination therapies in multiple sclerosis. – Journal of Neurology. 2008, supplement 1: 51-60.
20. Д.В. Сазонов, Н.А. Малкова. // Клиническая эффективность длительной иммуносупрессивной терапии быстро прогрессирующего рассеянного склероза. - Сибирский консилиум. 2007; 6 (61): 41-45.