КЛИНИЧЕСКАЯ ЭФФЕКТИВНОСТЬ, ПЕРЕНОСИМОСТЬ И ВЛИЯНИЕ НА КАЧЕСТВО ЖИЗНИ ИММУНОСУПРЕССИВНОЙ ТЕРАПИИ БЫСТРОПРОГРЕССИРУЮЩЕГО РАССЕЯННОГО СКЛЕРОЗА МИТОКСАНТРОНОМ В СОЧЕТАНИИ С МЕТИЛПРЕДНИЗОЛОНОМ
Сазонов Д.В., Бабенко Л.А., Малкова Н.А., Бабенко А.В.
Окружной Центр Рассеянного Склероза ФГУ СОМЦ Росздрава
Кафедра Клинической Неврологии и Алгологии ФПК и ППВ НГМУ
Рассеянный склероз (РС) – хроническое, прогрессирующее заболевание центральной нервной системы, проявляющееся рассеянной неврологической симптоматикой [1, 2]. Обычно заболевание начинается в молодом возрасте и практически неизбежно ведет к инвалидизации. Выключение в связи с инвалидизацией большого числа трудоспособных людей из активной жизни, большие расходы на диагностику, лечение, реабилитацию и социальную помощь делают проблему РС социально и экономически значимой [3].
Общепринято мнение, что РС, самое распространенное демиелинизирующее заболевание, является мультифакториальным. Его развитие обусловлено взаимодействием факторов внешней среды (вируса и/или другого патогена, экологических и географических факторов) и наследственной предрасположенностью, реализуемой полигенной системой, включающей особенности иммунного ответа и определенного типа метаболизма [4]. Сочетание внешних и генетических факторов в конечном итоге приводит к развитию аутоиммунного процесса, направленного против нервной ткани с образованием очагов демиелинизации и нейродегенерации [5].
Достаточно долгое время считалось, что перспектив для успешного лечения РС нет. Но благодаря появлению в арсенале современной медицины новых лекарственных препаратов и проведению международных исследований по изучению их эффективности, предложены качественно новые способы терапии РС, которые во многих случаях способствуют изменению течения заболевания.
Поскольку полного излечения в настоящее время достичь удаётся, основная цель терапии РС – замедление прогрессирования демиелинизирующего и нейродегенеративного процесса в ЦНС и, соответственно, предотвращение нарастания инвалидизации. Известно, что по мере увеличения длительности заболевания возрастает процент больных, у которых ремиттирующее течение трансформируется во вторично-прогредиентное, достигая 58%, 65% и 90% при длительности болезни 11-15, 16-25 и более 26 лет соответственно. У 1/3 больных эта стадия наступает через 5 лет болезни, у 1/2 – через 11 лет, а через 25 лет почти все больные имеют неуклонно прогрессирующее течение. Под хроническим прогрессированием понимают увеличение тяжести симптомов заболевания на протяжении не менее двух месяцев без стабилизации или улучшения. При этом заболевание может протекать с обострениями, минимальными ремиссиями и плато [6]. В настоящее время предложены единые критерии, определяющие характер прогрессирования РС. Так, если при вторично-прогредиентном РС ремиттирующий характер сменяется постепенным нарастанием симптоматики с редкими обострениями или без них, незначительными периодами стабилизации или ремиссиями, то при первично-прогредиентном РС заболевание прогрессирует с самого начала с редкими периодами стабилизации и временными незначительными периодами улучшения. Менее часто встречающееся ремиттирующе-прогредиентное течение характеризуется сочетанием клинически выраженных обострений с постоянным прогрессированием в период между ними с начала заболевания.
Рассеянный склероз существенно изменяет КЖ больного. Канадской группой изучения тяжести заболевания было проведено исследование КЖ у больных РС (198 больных) с использованием опросника SF-36. Результаты данного исследования выявили снижение показателей КЖ по всем шкалам в сравнении с контрольной группой здоровых лиц уже в начале заболевания. Авторами было сделано заключение о том, что применение опросника SF-36 при оценке тяжести течения и эффективности лечения при РС необходимо наравне с использованием шкалы EDSS, так как дает представление о психологических и социальных проблемах больных РС. Сходные данные были получены в исследовании, проведенном в Центре рассеянного склероза г. Новосибирска совместно с Межнациональным Центром исследования качества жизни г. Санкт-Петербурга [4]. Рядом исследователей отмечено, что физические проблемы больных в большей степени влияют на уровень КЖ, снижая его. Прослеживается очень тесная корреляция между шкалами, отражающими физическое состояние пациентов и расширенной шкалой инвалидизации Kurtzke EDSS.
В лечении РС можно выделить два направления: лечение обострений и патогенетическая терапия, направленная на изменение течения заболевания. К первому направлению терапии относятся препараты, способствующие более быстрому выходу из обострения при ремитирующем и ремиттирующее-прогредиентном течении РС. В эту группу можно отнести кортикостероиды, (метилпреднизолон, дексаметазон, препараты АКТГ), в определенной степени плазмаферез, циклоспорин А, а также ангиопротекторы и антиагреганты (хотя их терапевтический эффект не доказан в международных исследованиях). Второе направление лечения РС – препараты, изменяющие течение рассеянного склероза. В первую очередь к ним относятся препараты, уменьшающие частоту обострений при ремитирующем и вторично-прогредиентном с обострениями течении РС. Лидерами в этой группе являются препараты β-интерферона и глатирамера ацетат. Препаратами второго выбора являются исследуемые в настоящее время ингибиторы интегриновых и хемокиновых рецепторов, большие дозы иммуноглобулинов внутривенно. Другая группа препаратов патогенентической терапии – препараты, замедляющие быстрое прогрессирование необратимого неврологического дефицита, в том числе при первичном прогрессировании. В большинстве своём это препараты ряда цитостатиков: циклофосфан, азатиоприн, метотрексат, кладрибин, митоксантрон [7]. В настоящее время разработаны и применяются новейшие схемы лечения РС цитостатиками в сочетании с препаратами глюкокортикостероидов (митоксантрон+метилпреднизолон).
Рассеянный склероз – заболевание с доказанным аутоиммунным патогенезом, поэтому все стратегии лечения с доказанной эффективностью так или иначе имеют в механизме своего действия точки приложения в иммунной системе. Так, кортикостероиды применяемые, как правило, в пульс-дозах для лечения обострений РС прямо вызывают апоптоз активированных иммунокомпетентных клеток, что подавляет развитие и прогрессирование очага воспаления и демиелинизации в нервной ткани. Препараты превентивной терапии группы бета-интерферонов (Ребиф, Авонекс, Бетаферон) реализуют своё действие через «закрытие» гематоэнцефалического барьера путём снижения экспрессии молекул адгезии и через индукцию апоптоза аутореактивных Th1-лимфоцитов. Копаксон (глатирамера ацетат), также относящийся к препаратам превентивной терапии, индуцирует образование на периферии ОБМ-реактивных Th2-супрессоров, которые в свою очередь находятся в антагонистических отношениях с аутореактивными Th1-хелперами. Бета-интерфероны и копаксон обладают мягким модулирующим эффектом на иммунную систему, поэтому их применение показано на ранних стадиях заболевания и при относительно благоприятном течении РС, когда ещё не исчерпаны резервы иммунокоррекции. По достижении высоких баллов инвалидизации (более 4,0) достоверно её скорость замедляет лишь Бетаферон, тогда как другие препараты превентивной терапии пока убедительно не доказали своей эффективности. На более поздних стадиях заболевания и в тех случаях, когда течение приобретает злокачественный характер, либо является таковым с самого дебюта, иммуномодулирующей терапии недостаточно и встаёт вопрос о назначении иммуносупрессивных препаратов, в качестве которых традиционно применяют некоторые цитостатики: циклофосфан, метотрексат и азатиоприн. В последние годы всё более широкое применение в терапии быстропрогрессирующего и резистентного к терапии РС находят так называемые «цитостатики второго поколения» – синтетические противоопухолевые препараты, которые обладают узконаправленным действием на иммунокомпетентные клетки, такие как кладрибин и митоксантрон. Они имеют меньше побочных эффектов по сравнению с препаратами первого поколения и лучше переносятся больными.
Наиболее применяемой на сегодняшний день является терапия быстропрогрессирующего РС митоксантроном в сочетании с метилпреднизолоном.
Митоксантрон – синтетический противоопухолевый препарат. В онкологии митоксантрон применяют в основном при гемобластозах: неходжкинских лимфомах, острых лейкозах у взрослых, при обострениях хронического миелолейкоза, также он используется при метастазирующем раке молочной железы. Митоксантрон реализует свое противоопухолевое действие, интерполируясь в ДНК, и образуя разрывы цепи ДНК и межцепевые связи. Таким образом, препарат избирательно подавляет пролиферацию быстро делящихся клеток. Механизм действия препарата при рассеянном склерозе связан с подавлением активности CD4+ Th1-хелперов, В-клеток и стимуляции апоптоза воспалительных Т-клеток. По сравнению с другими химиопрепаратами, митоксантрон относительно прост в применении и имеет минимальное количество побочных эффектов в период приема. Тем не менее, при применении митоксантрона, как и других аналогичных химиотерапевтических препаратов, возможно угнетение кроветворения (лейкопения, тромбоцитопения, реже – эитроцитопения). Подобно другим антрациклиновым антибиотикам, митоксантрон оказывает кардиотоксическое действие. Могут возникать тошнота, рвота, понос, общая слабость, повышение температуры тела, аменорея, алопеция и другие побочные эффекты. Увеличивается риск развития у пациентов кардиотоксичности, проявляющейся в форме кардиомиопатии, в сокращении выделения фракций левого желудочка и в закупорке сердечных сосудов. Поэтому общая доза на продолжительности всей жизни, превышающая 140 мг/м2 не рекомендуется. Кроме того, существует опасение, что митоксантрон может увеличить вероятность развития злокачественных опухолей в будущем, поскольку его влияние на ДНК допускает теоретическую возможность мутагенного и канцерогенного действия.
Вводят раствор митоксантрона только внутривенно медленно (не быстрее чем в течение 5 мин) или в виде кратковременной капельной инфузии (в течение 15-30 мин). Препарат используют в стандартной дозировке 10-14 мг/м2 в сутки. Продолжительность курса лечения зависит от нозологии.
Исследования эффективности митоксантрона при рассеянном склерозе начались в конце 80-х годов прошлого века. После исследований на модели ЭАЭ, показавших, что митоксантрон подавляет развитие демиелинизации и воспаления, начались его клинические испытания.
В одном из исследований 42 пациентам (23, получавших митоксантрон, 19, получавших плацебо) регулярно проводилось МРТ исследование. У пациентов, получавших митоксантрон, была обнаружена тенденция к сокращению количества новых поражений на Т2-взвешенных изображениях. По результатам исследования можно предположить, что митоксантрон эффективно уменьшал активность заболевания у большинства пациентов по истечении 1 года с момента завершения лечения [8].
Целью другого рандомизированного контролируемого исследования было оценить эффективность митоксантрона и метилпреднизолона при лечении активного быстропрогрессирующего РС. В исследовании участвовало 5 университетских клиник Франции. В группе наблюдения 42 больных (средний возраст 32 года, 62% женщины) с подтвержденным РС, возраст от 18 до 45 лет; продолжительность РС <10 лет; прогрессирующая форма РС. Всем больным в/в вводили метилпреднизолон по 1 г/мес. и по 1 г/сут. в течение 3 дней в случае рецидива; 21 из 42 больных назначали также в/в введение митоксантрона по 20 мг/мес. У больных, получавших митоксантрон реже, чем у больных, не получавших его, наблюдались новые очаги поражения при обследовании через 2, 3, 5 и 6 мес. (р<0,05 для всех сравнений), отмечалось меньшее число очагов при каждом обследовании (р<0,05) и обострений РС (7 и 31 соотв.; р<0,01). Вероятность того, что обострение РС не наступит, в группе митоксантрона также была выше (р=0,03), однако у этих больных наблюдалось больше побочных реакций (61 и 11 соотв.). Различия между группами в средних значениях баллов по шкале EDSS появились только через 4 мес.; сравнение с исходным количеством баллов показало, что ухудшение в группе митоксантрона через 6 мес. было менее выраженным (p<0,01).
Были сделаны выводы, что при быстропрогрессирующем рассеянном склерозе комбинированное применение митоксантрона и метилпреднизолона уменьшает число и частоту появления новых подтвержденных очагов поражения и обострений, улучшает функциональный статус, оцениваемый по шкале EDSS. Частота развития побочных реакций при этом возрастает [9, 10].
В плацебо-контролируемом, двойном слепом, рандомизированном, многоцентровом исследовании 194 пациентам с ремиттирующе-прогредиентным или вторичным прогрессирующим РС было назначено плацебо или митоксантрон (5 мг/м2 внутривенно) каждые 4 месяца в течение 24 месяцев. Клинические оценки проводились каждые 3 месяца в течение 24 месяцев. Из 194 участвовавших в исследовании пациентов за год оказалось возможным оценить 188 человек. Серьезных побочных эффектов, вызванных препаратами, а также клинически значимых кардиологических дисфункций не наблюдалось. В целом митоксантрон хорошо переносился и сокращал прогрессирование инвалидизации и клинических осложнений [11].
В другом исследовании изучалась иная схема введения митоксантрона. 75 пациентам (из них 34 с ремиттирующим течением, 24 – со вторично-прогредиентным и 17 – с первично-прогредиентным) препарат вводился в дозировке 12 мг/м2 каждые 3 месяца. Наиболее эффективным лечение оказалось в группе с ремиттирующим течением: частота обострений уменьшилась на 48,4%, 30% пациентов не имели новых обострений, 55% больных не имели ухудшения по шкале EDSS за два года терапии [12].
Помимо клинических и нейровизуализационных изучается и лабораторные критерии эффективности терапии митоксантроном. В последних исследованиях показано, что митоксантрон, помимо уже известного влияния на Т-клетки, значительно снижает уровень аутореактивных В-клеток. Обследовались 18 больных ремиттирующим и вторично-прогредиентным РС, получающие терапию митоксантроном в дозировке 10 мг/м2 каждые три месяца в течение года. Было показано, что уже после 3 месяцев терапии абсолютное число В-клеток снизилось с 14,1±2.1% до 7,5±1.8% и с 1415±394 клеток/мкл до 819±348 клеток/мкл, причём этот эффект сохранялся и усиливался через 9 и 12 месяцев наблюдения. При этом общее число Т-клеток (без разделения на субпопуляции) не претерпевало существенных изменений. Это свидетельствует о том, что влияние на В-клетки является важным направлением в механизме действия митоксантрона и во многом определяет его клиническую эффективн6ость [13].
В настоящее время продолжается рассмотрение вопросов о показаниях и осложнениях лечения митоксантроном. Предполагается, что митоксантрон должен применяться для лечения пациентов, находящихся на ремиттирующей стадии с частыми обострениями, вероятнее всего ведущими к тяжелой инвалидизации и пациентов с вторичным прогрессирующим РС, уровень прогрессирования инвалидизации которых увеличивается на 1 и более единиц по шкале EDSS в год и которые не поддаются лечению другими современными стандартными методами терапии [14, 15]. Применение митоксантрона у пациентов с первично-прогредиентным течением находится в стадии изучения. Данные последних исследований говорят о необходимости дальнейшего изучения эффективности митоксантрона при лечении больных с РС.
На сегодняшний день в отборе пациентов для включения в программу иммуносупрессивной терапии мы руководствуемся следующими критериями:
- Достоверный диагноз рассеянного склероза согласно критериям W. Ian McDonald;
- Степень инвалидизации по шкале Куртцке EDSS 3-7 баллов;
- Продолжительность заболевания более 1 года;
- Быстрое прогрессирование, высокая активность болезни (+1,0 и более баллов за последний год);
- Возраст до 55 лет;
- Активные очаги с накоплением контраста по данным МРТ;
- Неэффективность предшествующей стандартной терапии;
- Достаточная мотивация больного;
- Отсутствие тяжёлой соматической патологии.
Критерии исключения для проведения иммуносупрессивной терапии:
- Рецидивирующая форма РС с редкими обострениями;
- Оценка по шкале Куртцке EDSS менее 3 и более 7 баллов;
- Прогрессирование болезни менее чем на 1 балл за последний год;
- Умственная (ментальная дисфункция) больного;
- Тяжелая сопутствующая патология (заболевания сердечно-сосудистой, дыхательной, мочеполовой систем);
- Несогласие больного.
Материалы и методы.
На настоящий момент под нашим наблюдением находится 50 больных РС, из них 18 мужчин и 32 женщины, средний возраст к началу терапии составил 32,7 лет (19-50). Средняя длительность заболевания к началу терапии составляет 7,82 лет (2-29). Средняя скорость прогрессирования составила 1,51 балла в год. 27 больных закончили лечение, 23 продолжают терапию. На момент начала терапии 45 пациентов имели вторично-прогредиентное течение, 3 пациента – первично-прогредиентное, 2 пациента – ремиттирующе-прогредиентное. Оценка выраженности неврологического дефицита по шкале Куртцке EDSS в среднем составила 5,6 баллов (4,0-7,5) до начала терапии.
Оценку эффективности терапии в нашем исследовании мы проводили с использованием показателей EDSS до начала исследования, перед каждым курсом терапии и после её завершения. В качестве метода нейровизуализации мы использовали МРТ головного мозга с контрастированием (омнискан). Все пациенты перед началом лечения, после шестого и заключительного курсов терапии проходили УЗИ сердца для исключения вероятной кардиомиопатии и ЭКГ перед каждым курсом. Все больные в процессе лечения проходили общеклиническое обследование: общий анализ крови с подсчётом лейкоцитарной формулы, общий анализ мочи, биохимический анализ крови, ЭКГ, оценку жизненноважных показателей (АД, ЧСС, ЧД), общесоматического статуса.
Для оценки качества жизни (КЖ) нами используется стандартный опросник SF-36. Опросник содержит 36 вопросов, охватывающих восемь основных характеристик здоровья, касающихся физического функционирования (ФФ), ролевого физического (РФФ) и эмоционального функционирования (РЭФ), оценки боли (Б), социального функционирования (СФ), общего здоровья (ОЗ), психического здоровья (ПЗ), жизнеспособности (Ж). Исследование показателей КЖ мы проводили до начала лечения (SF-1), после первого курса ИСТ (SF-2), после 3, 6 и 10 курсов ИСТ (SF-3, SF-4, SF-5 соответственно). Оценка корреляционных связей проводилась по показателям КЖ до начала терапии (SF-1) и по показателям EDSS через 24 месяца терапии, то есть после 10 курса лечения.
В нашем Центре иммуносупрессивная терапия по протоколу «Митоксантрон + Метилпреднизолон» проводится с 2002 г. Нами используется следующая схема иммуносупрессивной терапии: 1 курс включает введение 10 мг на м2 поверхности тела внутривенно капельно митоксантрона и 5 г метилпреднизолона. 2 и 3 курсы – 10 мг на м2 митоксантрона и 1 г метилпреднизолона. В дальнейшем проводится монотерапия митоксантроном в прежней дозе с интервалом 8-12 недель. Рекомендуемое количество курсов терапии стандартного протокола составляет 10-12 введений митоксантрона (рис. 1). По личным и финансовым (ввиду отсутствия митоксантрона и метилпреднизолона в списках федерального и областного льготного обеспечения до 2005 г) причинам более половины больных не прошли рекомендуемого полного курса иммуносупрессивной терапии: у 27 пациентов, завершивших лечение, среднее число курсов составило 6,7. 5 пациенток после нескольких курсов иммуносупрессивной терапии были включены в программу аутотрансплантации стволовых кроветворных клеток.
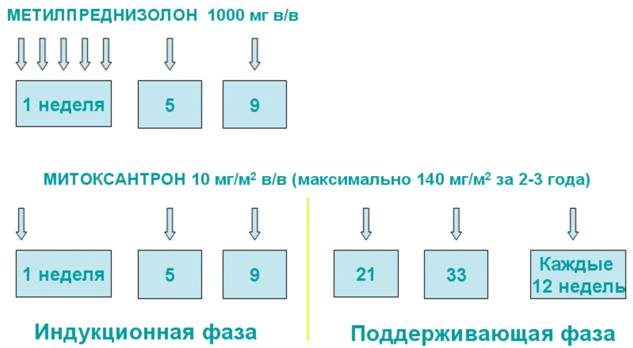
Рис. 1. Протокол иммуносупрессивной терапии «Митоксантрон + Метилпреднизолон» при быстро прогрессирующем рассеянном склерозе.
Результаты и обсуждение.
Эффективность лечения, оцениваемая по изменению показателей инвалидизации пошкале EDSS, была следующей; с улучшением – 56% (28 больных, из них с улучшением на 0,5 балла – у 16-ти, на 1,0 балл – у 7-и, на 1,5 балла – у 5-ти), со стабилизацией состояния – 36% (14 больных), с ухудшением – 16% (8 больных) (рис. 2).
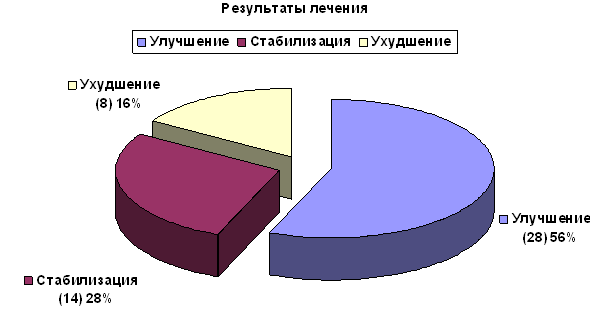
Рис. 2. Эффективность иммуносупрессивной терапии по протоколу «Митоксантрон + Метилпреднизолон».
Динамика степени тяжести по шкале EDSS соответственно курсам ИСТ отражена на графике (рис. 3). Для достоверности оценки нами была отобрана группа из 28 человек, прошедших не менее 6 курсов терапии (1 год лечения). Среднее исходной значение EDSS (перед проведением первого курса терапии) составило 5,5 баллов. Сразу же после первого курса среднее значение инвалидизации достоверно снизилось, составив 5,4 баллов, оставаясь неизменным вплоть до четвёртого курса ИСТ, после чего показатель вновь достоверно снизился на 0,1 балла, достигнув 5,3 баллов и оставался таким же и после шестого курса.

Рис. 3. Динамика инвалидизации по шкале EDSS на фоне иммуносупрессивной терапии по протоколу «Митоксантрон + Метилпреднизолон» (*-p<0,05).
Количественная оценка эффективности ИСТ проводилась по разнице значений EDSS перед началом лечения и после его завершения. Из 28-и пациентов с положительной динамикой большинство (16) имели регресс балльности на 0,5 баллов, семеро – на 1 балл и пятеро – на 1,5 балла. Из 8-и пациентов с ухудшением состояния большинство (четверо) имели прирост степени тяжести по EDSS 0,5 балла, двое – 1 балл и по одному 1,5 и 3,5 балла (Рис. 4).

Рис. 4. Эффективность иммуносупрессивной терапии по протоколу «Митоксантрон + Метилпреднизолон» по динамике балла EDSS за курс лечения.
Поскольку больные имели различную степень инвалидизации по EDSS и стаж заболевания на момент включения в программу иммуносупрессивной терапии, нами была предпринята оценка эффективности лечения митоксантроном в сочетании с метилпреднизолоном в зависимости от этих показателей.
Вся группа больных была разделена на две подгруппы: подгруппа со средней степенью тяжести по шкале EDSS (6,0 баллов и менее) составила 36 человек; подгруппа с тяжёлой инвалидизацией по EDSS (более 6,0 баллов) составила 14 человек (рис. 5). Между двумя подгруппами не было статистических различий в количестве больных с улучшением (55,5% и 57% соответственно), однако, количество больных ухудшением было в полтора раза меньше в группе со средней степенью тяжести (14% против 21,5% в группе с тяжёлой инвалидизацией).
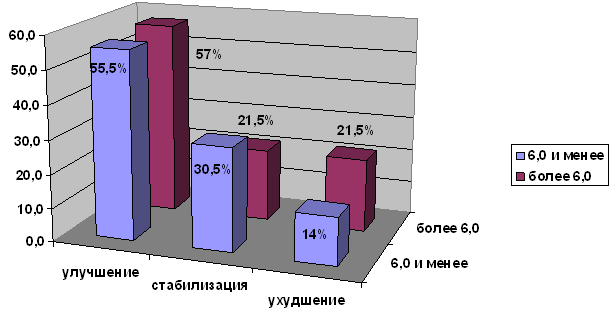
Рис. 5. Эффективность иммуносупрессивной терапии по протоколу «Митоксантрон + Метилпреднизолон» в зависимости от степени тяжести по EDSS.
По длительности заболевания группа больных была разделена на три подгруппы: первую составили больные со стажем заболевания 5 лет и менее, вторую – от 6 до 10 лет, третью – более 10 лет (рис. 6). В результате статистически значимых различий между второй и третьей подгруппами не было обнаружено, в то время как в группе больных с длительностью заболевания 5 и менее лет не было ни одного случая ухудшения состояния по шкале EDSS, а количество больных с улучшением было в 1,7 раза больше по сравнению со второй и третьей группами (71% против 47% и 40% соответственно).

Рис 6. Эффективность иммуносупрессивной терапии по протоколу «Митоксантрон + Метилпреднизолон» по длительности заболевания к началу ИСТ.
Таким образом, было установлено, что эффективность иммуносупрессивной терапии уменьшается с увеличением продолжительности заболевания степени тяжести по EDSS к моменту включения в программу.
Кроме того, нами проводилось исследование качества жизни (КЖ) больных РС на фоне проведения ИСТ. В связи с тем, что РС ведет к существенным нарушениям физического, психического, духовного и социального функционирования больного, оценка КЖ на фоне лечения РС представляется весьма актуальной. Изучение динамики КЖ больных обеспечивает индивидуальный мониторинг ранних и поздних результатов лечения, повышает качество оценки эффективности терапии митоксантроном и метилпреднизолоном. В исследование КЖ было включено 28 больных, получающих лечение по протоколу ИСТ, из них 7 мужчины и 21 женщины. Средний возраст больных на момент обследования был 31 лет±0,46 год (от 21 до 45 лет). Средняя продолжительность заболевания до начала программы терапии составлял от 1 до 22 лет, в среднем 6,96±0,47 лет. Средний возраст начала болезни – 24,16±0,46 лет (от 15 до 46 лет). Неврологический дефицит по шкале Куртцке EDSS до начала терапии в среднем составлял 5,0 баллов (2,5-7,5) средняя скорость прогрессирования – 1,24.
В нашем исследовании получены следующие результаты: у пациентов особенно страдало до начала лечения ролевое физическое функционирования (18,75) и ролевое эмоциональное функционирование (27,38) и были значительно более высокие показатели по шкалам телесной боли (65,07) и психического здоровья (49,29) (Таб. 1). Отмечается сохранность постоянства распределения самых высоких и низких показателей КЖ после проведения ИСТ.
Таблица 1. Динамика изменений показателей КЖ на фоне проведения иммуносупрессивной терапии больных быстро прогрессирующим РС метилпреднизолоном и митоксантроном
|
|
ФФ |
РФФ |
Б |
ОЗ |
Ж |
СФ |
РЭФ |
ПЗ |
|
SF-1 |
33,21±4,46 |
18,75±6,38 |
65,07±5,2 |
38,89±3,16 |
39,82±3,93 |
43,30±3,72 |
27,38±6,19 |
49,29±3,44 |
|
SF-2 |
36,43±4,70 |
30,36±6,35 |
66,50±5,71 |
43,11±3,50 |
46,79±3,80 |
55,80±4,83 |
36,90±7,54 |
53,29±3,40 |
|
SF-3 |
34,29±4,66 |
25,00±6,80 |
65,96±5,36 |
46,96±3,22 |
48,39±3,63 |
50,45±4,10 |
30,95±7,46 |
52,86±3,46 |
|
SF-4 |
36,61±5,07 |
25,89±6,86 |
67,86±5,32 |
45,54±3,34 |
43,21±3,46 |
52,68±4,74 |
30,95±7,46 |
55,14±3,17 |
|
SF-5 |
37,14±5,29 |
29,46±7,5 |
66,29±5,22 |
44,68±3,46 |
42,14±3,35 |
53,57±5,18 |
26,19±7,14 |
55,14±3,17 |
После 10 курса ИСТ показатели ОЗ, СФ, ПЗ имеют статистически значимый уровень улучшения, по остальным шкалам можно говорить о тенденции к улучшению, за исключением ролевого эмоционального функционирования, которое незначительно снижено, что можно объяснить длительностью терапии и возможным влиянием на психологическое состояние побочных эффектов лечения (Таб. 2, Рис. 7).
Таблица 2. Показатели КЖ до начала иммуносупрессивной терапии и после 10 курса лечения
|
|
ФФ |
РФФ |
Б |
ОЗ |
Ж |
СФ |
РЭФ |
ПЗ |
|
SF-1 |
33,21±4,46 |
18,75±6,38 |
65,07±5,2 |
38,89±3,16 |
39,82±3,93 |
43,30±3,72 |
27,38±6,19 |
49,29±3,44 |
|
SF-5 |
37,14±5,29 |
29,46±7,5 |
66,29±5,22 |
44,68±3,46 |
42,14±3,35 |
53,57±5,18 |
26,19±7,14 |
55,14±3,17 |
|
|
н/д |
н/д |
н/д |
p<0,05 |
н/д |
p<0,05 |
н/д |
p<0,05 |
Рис. 7. Показатели КЖ до начала иммуносупрессивной терапии и после 10 курса лечения
На основании результатов исследования можно сделать вывод, что длительная иммуносупрессивная терапия митоксантроном в сочетании с метилпреднизолоном быстро прогрессирующего РС способствует улучшению КЖ, как его физического (ФФ, РФФ, Б, ОЗ) , так и психологического (ПЗ, РЭФ, СФ, Ж) компонентов. (Рис. 8). Положительная динамика при оценке общего здоровья, социального функционирования и психического здоровья являются статистически значимыми (p<0,05).
Динамика КЖ на фоне проведения ИСТ отражает сущность и влияние терапии на состояние пациентов. Его основное направление – стабилизация быстро прогрессирующего течения болезни. Отсюда имеется четкая тенденция в улучшении ролевого физического и социального функционирования больных и улучшение психологического состояния пациентов, улучшение общего здоровья.

Рис. 8. Изменение психологического и физического компонентов КЖ на фоне ИСТ у больных быстро прогрессирующим РС
Мы исследовали прогностическую роль корреляции показателей КЖ до лечения и изменениями баллов по шкале EDSS через 24 месяца терапии. Низкие значения показателей КЖ коррелируют с возрастанием EDSS после двух лет терапии. Сильная, статистически значимая корреляция обнаружена для шкал ролевого физического функционирования (РФФ) общего здоровья, жизнеспособности и социального функционирования, Наиболее выраженная (-0,398, p<0,05) оказалась корреляция между увеличением EDSS и низким значением социального функционирования до начала лечения, а минимальной (0,116, н/д) – между EDSS и показателем боли (Таб. 3).
Таблица 3. Корреляционные связи между показателями качества жизни больных РС до начала ИСТ и изменениями EDSS в течение 12 месяцев после начала терапии
|
Шкалы опросника SF-36 |
Коэффициенты корреляции (r) |
Вероятность ошибки (p) |
|
ФФ (физическое функционирование) |
-0,193 |
н/д |
|
РФФ (ролевое физическое функционирование) |
-0,343 |
p<0,05 |
|
Б (боль) |
0,116 |
н/д |
|
ОЗ (общее здоровье) |
-0,314 |
н/д |
|
Ж (жизнеспособность) |
-0,438 |
p<0,05 |
|
СФ (социальное функционирование) |
-0,398 |
p<0,05 |
|
РЭФ (ролевое эмоциональное функционирование) |
-0,190 |
н/д |
|
ПЗ (психическое здоровье) |
-0,206 |
н/д |
В группе больных наблюдались следующие побочные эффекты: шесть случаев мочевой инфекции, пять случаев обострения хронического заболевания (хронический пиелонефрит, ХПН0), гидраденит подмышечной области – один случай, стоматит 1 степени – один случай, тахикардический синдром – шесть случаев, один случай Herpes Zoster, тромбоцитопения и нейтропения зафиксированы у семи больных, нарушение менструальной функции – у семи пациенток. У ряда пациентов отмечены ситуации, возможно, не связанные с иммуносупрессивной терапией: у одного пациента на фоне лечения развилась нейропатия локтевого нерва, у двух пациентов – артроз коленных суставов, также был зафиксирован один случай попытки суицида (у тяжело инвалидизированного больного через год после завершения ИСТ). У всех пациентов проявления гематологической токсичности были не выше 1 степени по критериям ВОЗ, местных реакций на введение препаратов не отмечалось.
Выводы.
1. У большинства больных (84%) на фоне терапии митоксантроном в сочетании с метилпреднизолоном после быстрого прогрессирования отмечается стабилизация или улучшение состояния по шкале EDSS.
2. Наилучший эффект иммуносупрессивная терапия митоксантроном в сочетании с метилпреднизолоном даёт у больных с небольшим стажем заболевания (до 5 лет) и с небольшой степенью инвалидизации по EDSS (3,0-6,0 баллов).
3. Иммуносупрессивную терапию по протоколу «Митоксантрон + Метилпреднизолон» больные переносят удовлетворительно. Тяжелых осложнений на фоне лечения не отмечено.
4. Анализ показателей качества жизни у больных быстро прогрессирующим РС показывает, что более всего страдает физическая составляющая качества жизни, а именно – физическое, ролевое физическое функционирование и одна из психологических составляющих – ролевое эмоциональное функционирование;
5. На основании результатов исследования можно сделать вывод, что длительная иммуносупрессивная терапия митоксантроном в сочетании с метилпреднизолоном быстро прогрессирующего РС способствует улучшению КЖ, как его физического (ФФ, РФФ, Б, ОЗ), так и психологического (ПЗ, РЭФ, СФ, Ж) компонентов.
6. Показатели КЖ больного РС, измеренные до начала иммуносупрессивной терапии, обладают определенной прогностической значимостью и коррелируют с изменением показателей EDSS в результате лечения.
Таким образом, использование митоксантрона в сочетании с метилпреднизолоном позволяет затормозить прогрессирование иммунопатологического процесса в центральной нервной системе, в большом проценте случаев добиться улучшения или стабилизация состояния больных с быстро прогрессирующим РС. Дальнейшие исследования позволят уточнить показания для проведения этого лечения.
Литература
1. Е.И. Гусев, И.А. Завалишин, А.Н. Бойко // Рассеянный склероз и другие демиелинизирующие заболевания - 2004.
2. Е.И. Гусев, Т.Л. Демина, А.Н. Бойко // Рассеянный склероз - 1997. - С. 2.
3. Т.Е. Шмидт, Н.Н. Яхно // Рассеянный склероз. – 2003. - С.7.
4. Н.А. Малкова, А.П. Иерусалимский // Рассеянный склероз. - 2006. - С. 6, 123.
5. Е. И. Гусев, А.Н. Бойко // Рассеянный склероз: от новых знаний к новым методам лечения, Российский медицинский журнал - 2001. - №1. - С. 5.
6. Т.Е. Шмидт, Н.Н. Яхно // Рассеянный склероз. – 2003. - С. 122.
7. Е.И. Гусев, А.Н. Бойко // Рассеянный склероз: от изучения патогенеза к новым методам лечения. – 2001. - С. 43.
8. Watson CM, Davison AN et al. // Supression of demyelination by mitoxantrone. Int J Immunopharmacol. – 1991. - 13:923-930.
9. Millefiorini E, Gasperini C, Pozzilli C, et. all. // Randomized placebo-controlled trial of Mitoxantrone in Relapsing/Remitting Multiple Sclerosis: 24-month clinical and MRI outcome.
J Neurol. - 1997. - 244(3):153-159.
10. Edan G, Miller D, Clanet M, et. al. // Therapeutic effect of Mitoxantrone combined with Methylprednisolone in Multiple Sclerosis: a randomized multicentre study of active disease using MRI and clinical criteria. - J Neurol Neurosurgery Psychiatry – 1997. - 62(2):112-118.
11. Edan G., Miller D., Clanet M., et al. // Mitoxantrone plus methylprednisolone improved active multiple sclerosis. - J Neurol Neurosurgery Psychiatry 1997. - 62:112-8.
12.E. Kkolou, J. Toufexis, E. Gaglia, M. Pantzaris // Clinical effect of Mitoxantrone in patients with multiple sclerosis. – Multiple Sclerosis – Clinical and laboratory research, ECTRIMS 2006. P. 210.
13. N. Putzki, M. Kumar, E. Kreuzfelder, V. Limmroth // Mitoxantrone leads to a persistent selective decrease of the B cell count in patients with multiple sclerosis. – Multiple Sclerosis – Clinical and laboratory research, ECTRIMS 2006. P. 211-212.
14. Hartung HP, Gonsette R, Konig N, et. al. // Mitoxantrone in progressive multiple sclerosis: a placebo-controlled, double-blind, randomised, multicentre trial. - Lancet. 2003. - 29. - 361(9363):1133-4.
15. Mitoxantrone in progressive multiple sclerosis: when and how to treat? // Journal of the Neurological Sciences. - 2003. – 206 - P. 203-208.